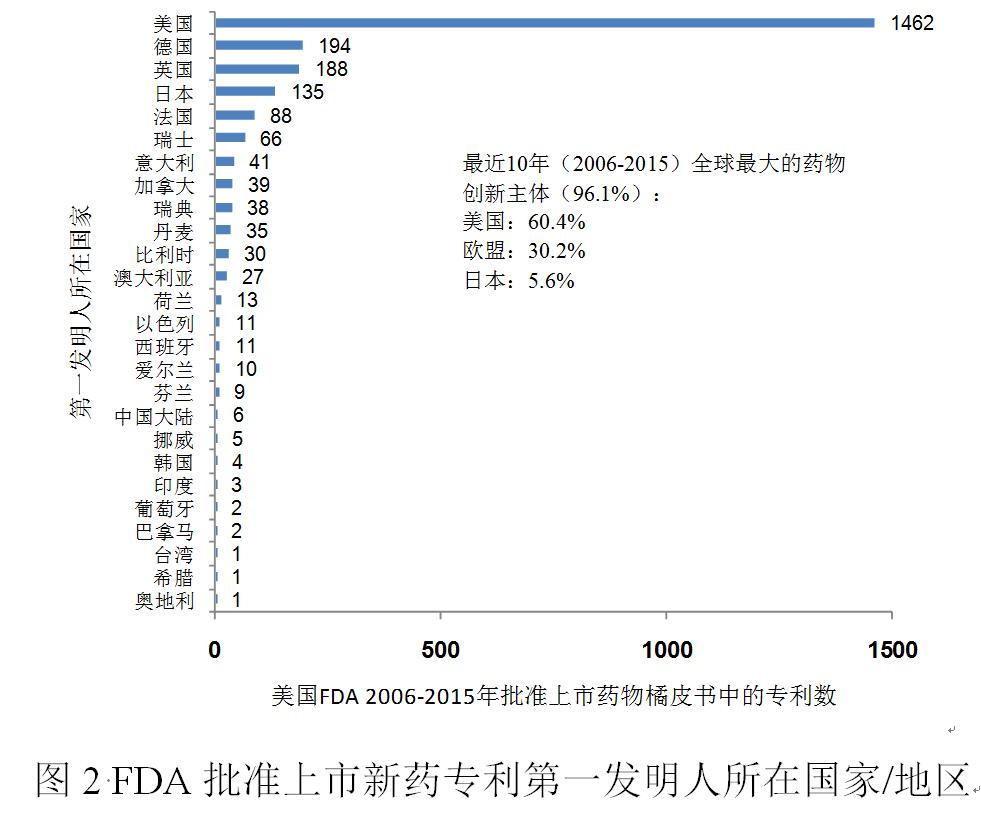
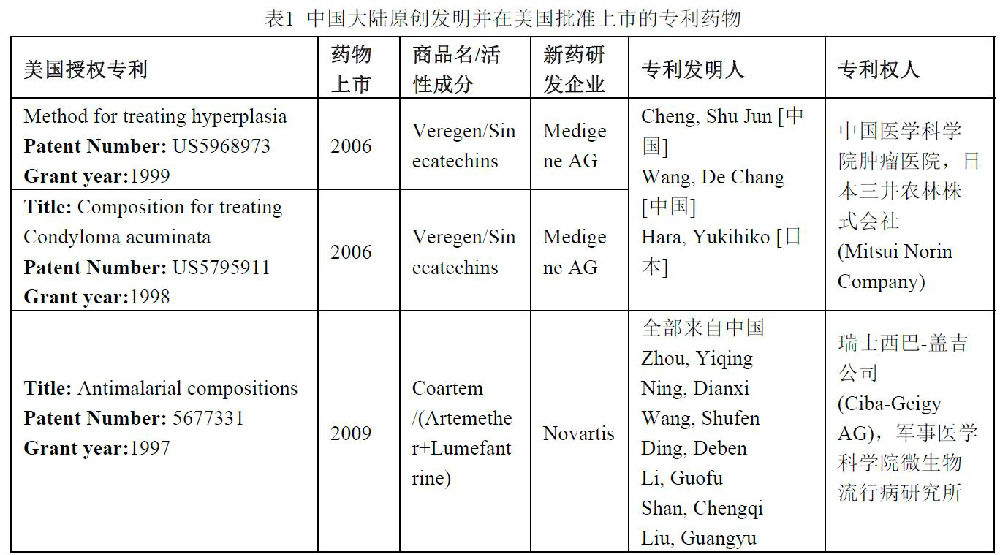
РВЛҺСР°l(fЁЎ)ЮD(zhuЁЈn)»ҜСРҫҝңy¶ИЕcФuғrөДМҪЛч
ХӘТӘ: ңy¶ИЎ°РВЛҺ®a(chЁЈn)Ж·-әЛРДҢЈАы-ҝЖјјХ“ОД-»щҪрЩYЦъЎұЦ®йgөДЦӘЧRкP(guЁЎn)В“(liЁўn)Ј¬ҪТКҫРВЛҺСР°l(fЁЎ)оI(lЁ«ng)УтҝЖҢW(xuЁҰ)-јјРg(shЁҙ)-®a(chЁЈn)Ж·Ц®йgөДЮD(zhuЁЈn)»ҜҢW(xuЁҰ)Б•(xЁӘ)МШХчәНТҺ(guЁ©)ВЙЈ¬МбіцҙЩЯMОТҮшбt(yЁ©)ЛҺ®a(chЁЈn)Ж·„“(chuЁӨng)РВөДХюІЯҪЁЧhЎЈ